"Man måste
börja med
åldrandeprocessen"
börja med
åldrandeprocessen"
Fakta om åldrandet
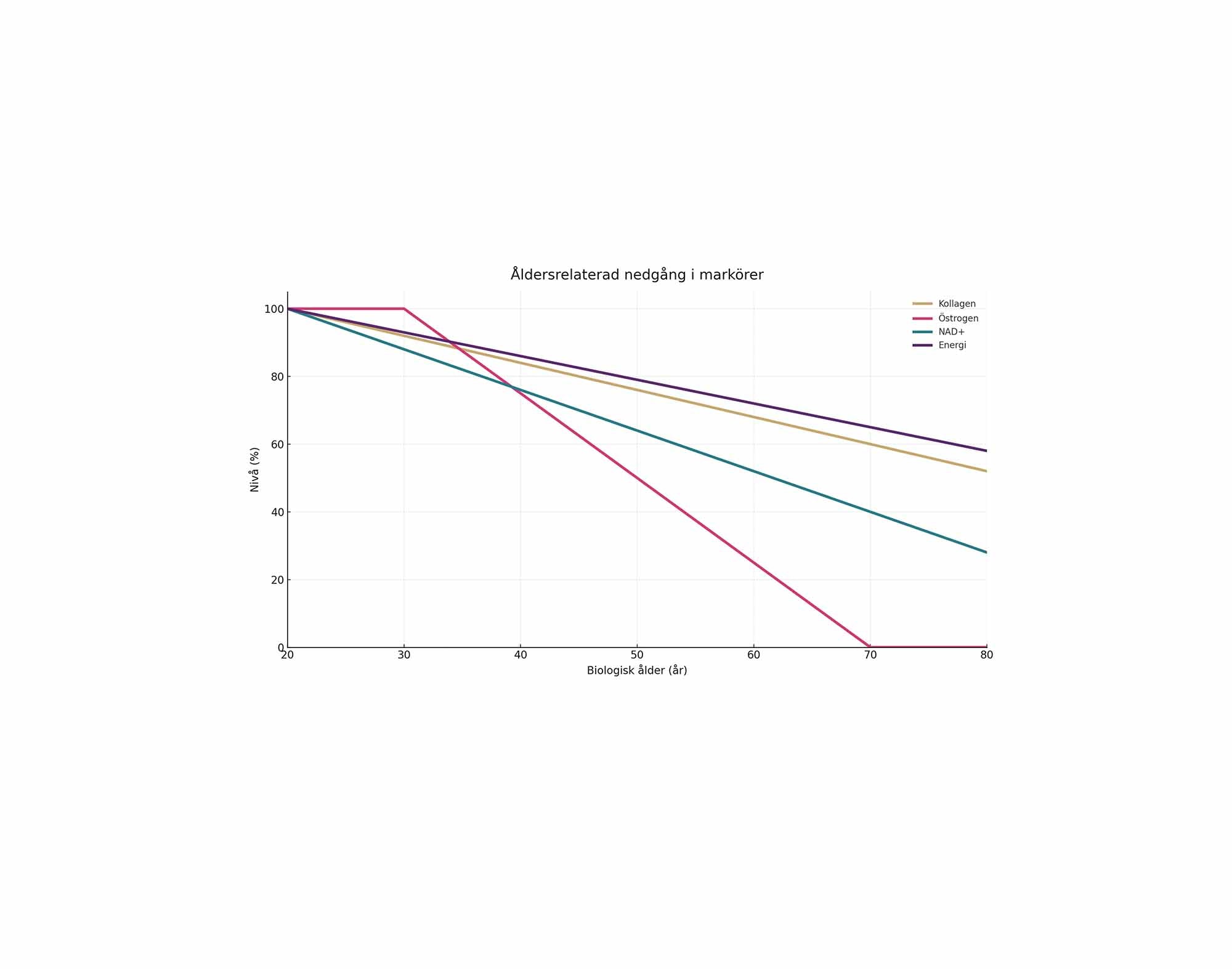
Man har fastslagit nio "hallmarks of aging", vilka är allmänt accepterade som de grundläggande processerna som bidrar till åldrandet. Dessa nio ålderstecken inkluderar:
Genomisk instabilitet – Skador på DNA som ackumuleras över tid.
Telomerförkortning – Förkortning av telomererna vid cellernas kromosomändar som sker vid varje celldelning.
Epigenetiska förändringar – Förändringar i genuttrycket som inte beror på förändringar i DNA-sekvensen.
Förlust av proteostas – Nedsatt förmåga att syntetisera, vika, och degradera proteiner korrekt.
Dysfunktionella mitokondrier – Skador på mitokondrierna, som är cellernas energikällor.
Cellulär senescens – När celler slutar dela sig och ackumulerar i vävnaden, vilket bidrar till åldrande och sjukdom.
Stamcellsutarmning – Minskning av antalet och funktionen hos stamceller, vilket påverkar vävnadernas förmåga att reparera sig själva.
Förändrad intercellulär kommunikation – Förändringar i hur celler kommunicerar med varandra, vilket kan leda till inflammatoriska processer och vävnadsdysfunktion.
Förändrad näringsupptagning – Förändringar i metabolismen och näringsupptagningen, vilket kan påverka åldrandet och sjukdomsutvecklingen.
Dessa hallmarks hjälper forskare att förstå de underliggande mekanismerna för åldrande och att utveckla potentiella strategier för att hantera eller försena åldersrelaterade förändringar och sjukdomar.
1. Hjärnans ”tvättsystem” (glymfatiska systemet)
Under djupsömnen öppnar sig ett speciellt system i hjärnan, det glymfatiska systemet, som spolar bort slaggprodukter.
Bland annat rensas beta-amyloid, ett protein kopplat till Alzheimers.
Dålig sömn → mer ansamling av dessa proteiner → ökad risk för demens.
2. Cellreparation och åldersmarkörer
Under sömn ökar produktionen av tillväxthormon (GH) och IGF-1, som är viktiga för reparation av muskler, ben och hud.
Sömnbrist leder till kortare telomerer (”ändskydd” på DNA), vilket är kopplat till snabbare biologiskt åldrande.
Celler får mer tid att reparera DNA-skador från stress, sol och fria radikaler.
3. Immunförsvaret
Under djupsömnen aktiveras immunförsvaret och kroppen producerar cytokiner, som hjälper till att bekämpa infektioner och inflammation.
Forskning visar att vaccin fungerar bättre när vi sover ordentligt – kroppen bygger starkare immunologiskt minne.
4. Hormonbalans & ämnesomsättning
Sömn reglerar kortisol (stresshormon). Brist ger kroniskt förhöjda nivåer → mer bukfett, sämre blodsocker, snabbare åldrande.
Reglerar leptin och ghrelin – hormoner som styr hunger/mättnad. Dålig sömn → ökad hunger → viktuppgång.
Påverkar även insulinkänslighet → sömnbrist är kopplat till ökad risk för typ 2-diabetes.
5. Hjärta och kärl
Under sömnen sjunker blodtryck och hjärtfrekvens, vilket ger kärlen ”vila”.
Sömnbrist ökar risk för högt blodtryck, åderförkalkning och hjärtinfarkt.
Studier visar att personer som sover för lite har högre risk för kardiovaskulära sjukdomar.
6. Mental hälsa & känsloreglering
Sömn stabiliserar amygdala (hjärnans ”alarmsystem”), vilket minskar oro och ångest.
Brist på REM-sömn gör att hjärnan överreagerar på negativa känslor.
God sömn förbättrar minne, koncentration och kreativitet genom att hjärnan ”sorterar” intryck och erfarenheter.
Sömn är kroppens bästa anti-aging-läkemedel:
Den förlänger telomerer
Rensar hjärnan från skadliga proteiner
Återställer hormoner och ämnesomsättning
Skyddar hjärta och immunförsvar
Håller psyket stabilt
1. Träning och biologisk ålder
Studier visar att personer som tränar regelbundet kan ha en biologisk ålder som är 10–15 år lägre än deras kronologiska ålder.
Träning bromsar förkortningen av telomerer (DNA:s ”ändskydd”), vilket är en central markör för åldrande.
Motion ökar aktiviteten av enzymet telomeras, som förlänger telomererna och håller cellerna friska längre.
2. Muskler och sarkopeni (åldersrelaterad muskelförlust)
Efter 30 års ålder förlorar vi i snitt 3–8% muskelmassa per decennium om vi är inaktiva.
Styrketräning motverkar denna förlust, och kan till och med bygga ny muskelmassa långt upp i åldern.
Muskler är inte bara för styrka – de fungerar som ett endokrint organ och utsöndrar myokiner som påverkar inflammation, metabolism och hjärnans hälsa.
3. Hjärtat, blodcirkulationen och mitokondrierna
Konditionsträning ökar mitokondriell biogenes – kroppen bygger fler och friskare mitokondrier (cellernas energifabriker).
Detta förbättrar cellernas energiproduktion och minskar oxidativ stress.
Regelbunden motion sänker blodtryck, förbättrar blodfetterna och minskar risken för hjärt-kärlsjukdomar, den vanligaste dödsorsaken globalt.
4. Hjärnan och kognition
Träning ökar produktionen av BDNF (Brain-Derived Neurotrophic Factor), ett protein som stimulerar tillväxt av nya nervceller och stärker kopplingarna mellan dem.
Fysisk aktivitet kan öka hippocampus volym (den del av hjärnan som styr minne), som annars krymper med åldern.
Regelbunden träning är kopplat till minskad risk för demens och Alzheimers.
5. Inflammation och immunförsvar
Åldrande kännetecknas av ”inflammaging” – kroniskt låggradig inflammation.
Träning minskar systemisk inflammation genom att dämpa pro-inflammatoriska cytokiner (t.ex. TNF-α) och öka antiinflammatoriska (t.ex. IL-10).
Motion stärker immunförsvaret och förbättrar kroppens förmåga att bekämpa infektioner.
6. Metabolism och hormoner
Motion förbättrar insulinkänslighet, vilket motverkar åldersrelaterad insulinresistens och typ 2-diabetes.
Träning stimulerar frisättning av tillväxthormon och testosteron/östrogen, som naturligt sjunker med åldern men är viktiga för muskelmassa, benstyrka och välbefinnande.
7. Benhälsa och åldrande
Viktbärande träning (gång, löpning, styrketräning) stärker skelettet genom att stimulera osteoblaster (benceller).
Detta minskar risken för osteoporos och benbrott – en av de största riskfaktorerna för sjukdom och dödlighet hos äldre.
Träning är en ”multimedicin” mot åldrande:
Håller DNA och telomerer unga
Bygger muskler och motverkar sarkopeni
Förnyar mitokondrier och ökar energin
Skyddar hjärnan och minnet
Dämpar inflammation och stärker immunförsvaret
Reglerar hormoner och metabolism
Skyddar skelettet
1. Testosteronets funktion i kroppen
Testosteron är inte bara ett ”sexhormon” – det är ett anaboliskt hormon som styr många system i kroppen:
Muskler & styrka – stimulerar proteinsyntes och motverkar muskelförtvining.
Benhälsa – ökar bentäthet genom att aktivera osteoblaster (benceller).
Fettfördelning – låga nivåer → mer bukfett (visceralt fett, kopplat till hjärtsjukdom).
Blodbildning – stimulerar produktion av röda blodkroppar.
Hjärnan – påverkar humör, motivation, kognition och minne.
Sexuell funktion – libido, erektion och fertilitet.
2. Naturligt åldrande & testosteronfall
Män når oftast sin toppnivå i 20-årsåldern.
Därefter sjunker nivåerna med i snitt 1–2 % per år från 30–40 års ålder.
Detta tillstånd kallas ibland för ”andropaus” – manlig motsvarighet till klimakteriet, men mer gradvis.
Hos kvinnor produceras testosteron i äggstockar och binjurar – även där minskar nivåerna efter 40–50 år.
3. Lågt testosteron (hypogonadism) är kopplat till:
Sarkopeni (förlust av muskelmassa)
Osteoporos (svaga ben)
Insulinresistens & diabetes typ 2
Metabolt syndrom (bukfetma, blodfetter, högt blodtryck)
Depression och trötthet
Ökad mortalitet – flera studier visar samband mellan lågt testosteron och förkortad livslängd.
4. Träning & testosteron
Styrketräning, särskilt med stora muskelgrupper (knäböj, marklyft), ökar akut testosteronnivåerna.
HIIT-träning kan också stimulera testosteron bättre än långvarig lågintensiv träning.
Långvarig överträning/kronisk stress sänker testosteronet via högt kortisol.
5. Kost, livsstil & testosteron
Zink, magnesium, vitamin D och tillräckligt med protein är viktiga byggstenar.
Friska fetter (t.ex. olivolja, avokado, ägg, nötter) stödjer hormonproduktionen.
Övervikt, särskilt bukfetma, sänker testosteron eftersom fettvävnad omvandlar testosteron till östrogen via enzymet aromatas.
Sömn: bara en vecka med 5 timmars sömn/natt kan sänka testosteron med upp till 15%.
6. Testosteronersättning (TRT) – forskningsläget
Kan förbättra muskelmassa, bentäthet, humör och sexuell funktion hos män med låga nivåer.
Risker: ökad produktion av röda blodkroppar (polycytemi), vilket kan belasta hjärtat; viss diskussion kring risk för prostataproblem (även om moderna studier inte visar ökad prostatacancer-risk vid korrekt användning).
Viktigt: bör endast ges till de med kliniskt låga nivåer och symptom – inte som ”anti-aging-kur” hos redan friska.
7. Testosteron & hjärnan
Testosteron påverkar neuroplasticitet och dopaminsystemet → motivation, fokus och belöningskänslor.
Låga nivåer är kopplade till depression, särskilt hos män.
Forskning visar att testosteron kan skydda mot Alzheimers via minskad amyloid-beta-ackumulering.
Testosteron är en nyckelfaktor för åldrande – påverkar muskler, ben, hjärta, hjärna och metabolism.
Nivåerna sjunker naturligt med åren, men livsstil (träning, kost, sömn, stresshantering) kan bromsa fallet.
Låga nivåer är kopplat till högre sjukdomsrisk och kortare livslängd.
Forskningen lutar allt mer åt att optimala nivåer av testosteron (varken för lågt eller för högt) är starkt kopplat till både hälsa och långlevnad.
Vad händer i kroppen vid fasta?
1. Energiomkoppling (metabolic switch)
Efter ~12–16 timmars fasta töms leverns glykogenlager.
Kroppen skiftar från glukos som huvudsaklig bränslekälla till fettsyror och ketonkroppar (β-hydroxybutyrat).
Denna omkoppling ökar mitokondriell effektivitet och minskar oxidativ stress.
2. Autofagi – cellernas städmaskin
Vid energibrist aktiveras autofagi, en process där cellen bryter ner skadade proteiner, organeller och avfallsprodukter.
Autofagi är central för att förebygga neurodegenerativa sjukdomar (t.ex. Alzheimers, Parkinsons) där proteinaggregat ansamlas.
Mekanismer: hämning av mTOR och aktivering av AMPK → signalvägar som triggar cellreparation.
3. DNA-reparation och stressresiliens
Fasta ökar uttrycket av gener kopplade till DNA-reparation och cellöverlevnad (sirtuiner, FOXO, NRF2).
Ketoner fungerar som signalmolekyler och ökar antioxidativa försvarssystem.
Detta gör cellerna mer motståndskraftiga mot oxidativ stress – en nyckelfaktor i biologiskt åldrande.
4. Hormonella förändringar
Insulin och IGF-1 sjunker → lägre anabol signalering, vilket paradoxalt nog ökar livslängd i djurmodeller genom att minska celltillväxt och cancerdrivande processer.
Tillväxthormon (GH) stiger kraftigt under fasta → stimulerar lipolys och bevarar muskelmassa.
Leptin sjunker, adiponektin ökar → förbättrad insulinkänslighet och fettförbränning.
5. Inflammation och immunförsvar
Fasta sänker nivåerna av pro-inflammatoriska cytokiner (t.ex. TNF-α, IL-6).
Studier visar att fasta kan ”resetta” immunsystemet genom att stimulera stamceller i benmärgen att producera nya immunceller efter återföding.
Effekten: mindre kronisk låggradig inflammation (”inflammaging”).
6. Epigenetiska effekter
Fasta påverkar epigenetiska mekanismer som histondeacetylering via ökad sirtuinaktivitet.
Detta kan fördröja cellulärt åldrande genom att bevara genuttrycksmönster associerade med lång livslängd.
Evidens i människor
CALERIE-studien (2 år med kalorirestriktion, ~12 %) visade:
Minskad biologisk ålder (mätt via epigenetiska klockor).
Förbättrad insulinkänslighet, blodtryck, LDL och inflammationsmarkörer.
Periodisk fasta & 5:2-modeller: förbättrar metabol hälsa och markörer för åldrande, men långtidseffekter på livslängd hos människor är ännu inte fastställda.
Fasta + cancerbehandling: vissa kliniska studier visar att korttidsfasta kan minska biverkningar av kemoterapi och öka tumörernas känslighet.
När man fastar sker en kaskad av åldringsskyddande processer:
Metabol switch → mer effektiva och renare energikällor.
Autofagi → städar bort skadade cellkomponenter.
Lägre IGF-1/insulin → minskad risk för cancer och metabola sjukdomar.
DNA-reparation & sirtuiner → ökad cellresiliens.
Mindre inflammation → starkare immunförsvar och skydd mot kroniska sjukdomar.
Vad händer i kroppen vid kyla?
1. Stressrespons & hormoner
Kall exponering aktiverar det sympatiska nervsystemet → frisättning av noradrenalin och adrenalin.
Noradrenalin kan minska inflammation (hämmar t.ex. TNF-α) och förbättra mental vakenhet.
Kortvarig stress från kyla fungerar som en form av hormetisk stress – samma princip som träning eller fasta: lite stress gör kroppen starkare.
2. Brunt fett & metabolism
Kyla aktiverar brunt fett (BAT) och stimulerar ”beige” fettceller → ökad termogenes.
Brunt fett förbränner glukos och fett för värmeproduktion, vilket kan förbättra insulinkänslighet och minska risk för metabolt syndrom.
Hos äldre minskar brunt fett naturligt – kyla kan delvis motverka detta.
3. Mitokondriell hälsa
Kall exponering stimulerar PGC-1α och mitokondriell biogenes (nybildning av mitokondrier).
Mer och friskare mitokondrier = bättre energiproduktion, mindre oxidativ stress – två nyckelfaktorer i långsamt åldrande.
4. Inflammation & immunförsvar
Studier visar att regelbunden kallträning kan öka nivåerna av antiinflammatoriska cytokiner (IL-10) och minska pro-inflammatoriska (IL-6, TNF-α).
Den nederländska studien på Wim Hof-metoden visade att deltagare som tränat andning + kallbad kunde modulera sitt immunförsvar och få låggradigare inflammationssvar vid infektion.
5. Proteiner kopplade till åldrande
Kyla ökar nivåerna av FGF21 (fibroblast growth factor 21), ett hormon associerat med förbättrad metabolism och livslängd i djurmodeller.
Aktiverar även sirtuiner (SIRT3) i mitokondrier, vilket är kopplat till cellernas stresstålighet och längre livslängd.
6. Mental hälsa & neuroplasticitet
Isbad frisätter endorfiner och dopamin (vissa studier visar upp till +250 % ökning av dopamin efter kallbad).
Detta kan förbättra humör, motivation och hjärnans motståndskraft mot stress – indirekt viktigt för långsiktig hjärnhälsa.
Evidens i människor
Epidemiologiska studier från t.ex. Finland (isbads-/bastukultur) visar samband mellan kallbad, bättre cirkulation och självskattad hälsa, men orsakssambanden är osäkra.
Interventionsstudier är små men visar förbättrad insulinkänslighet, minskad oxidativ stress och bättre immunrespons.
Inga långsiktiga studier som bevisar ökad livslängd hos människor – men flera mekanismer (mitokondrier, inflammation, brunt fett) är starkt kopplade till hälsospan.
Isbad kan fungera som en form av hormetisk stress – en kortvarig ”chock” som gör kroppen mer motståndskraftig.
Effekterna som kan kopplas till åldrande är:
När östrogennivåerna sjunker under klimakteriet genomgår kroppen en rad förändringar. Några vanliga effekter är:
Värmevallningar och svettningar: Plötsliga värmeattacker med efterföljande svettningar är ett av de mest typiska symptomen.
Sömnstörningar: Minskad östrogen kan leda till sömnproblem och därmed trötthet under dagen.
Humörsvängningar: Förändringar i hormonbalansen kan påverka humöret, vilket kan innebära ökad irritabilitet eller nedstämdhet.
Vaginal torrhet och minskad sexlust: Östrogen är viktigt för att upprätthålla fukt och elasticitet i slemhinnorna, och dess minskning kan leda till obehag och nedsatt libido.
Förändrad hud och elasticitet: Huden kan bli tunnare och tappa sin elasticitet, vilket bidrar till torrare hud och ökad rynkbildning.
Ökad risk för benskörhet: Låga östrogennivåer påverkar benmassan negativt, vilket med tiden kan öka risken för osteoporos.
Mekanismer – vad händer i kroppen vid bastu?
1. Kardiovaskulär träningseffekt
Bastubad höjer hjärtfrekvensen till samma nivå som måttlig träning (upp mot 120–150 slag/min).
Blodkärlen dilaterar → bättre blodflöde och sänkt blodtryck efteråt.
Regelbunden värmeexponering förbättrar endotelcellernas funktion och ökar kväveoxid (NO), som skyddar kärlen.
2. Heat Shock Proteins (HSPs)
Värmeexponering aktiverar heat shock response → ökad produktion av HSP70, HSP90.
Dessa proteiner hjälper till att reparera skadade proteiner och motverka protein-aggregationer, en central mekanism i åldrande och neurodegeneration (t.ex. Alzheimers).
HSP-aktivering är kopplat till ökad cellresiliens och långsammare åldersrelaterade nedbrytningsprocesser.
3. Metabolism & hormoner
Bastu sänker kortisolnivåer och kan förbättra balans i stresshormoner.
Insulinkänslighet förbättras vid regelbundet bastubad, vilket kan minska risken för typ 2-diabetes.
Värmeexponering ökar också nivåerna av tillväxthormon (GH) temporärt, vilket stödjer reparation och underhåll av vävnader.
4. Inflammation & immunförsvar
Bastu minskar systemisk låggradig inflammation (”inflammaging”) genom att sänka CRP och IL-6 i flera studier.
Cirkulerande vita blodkroppar kan öka, vilket stärker kroppens immunförsvar.
Effekten liknar den från regelbunden aerob träning.
5. Neuroprotektion & hjärnhälsa
Regelbunden bastu ökar nivåerna av BDNF (Brain-Derived Neurotrophic Factor) → stödjer neuroplasticitet och skyddar mot kognitiv nedgång.
Minskad risk för demens och Alzheimers har observerats i stora epidemiologiska studier.
Evidens från humanstudier
Den finska Kuopio Ischemic Heart Disease Study (KIHD)
2 000 män följdes i 20+ år.
Resultat:
4–7 bastubad/vecka → 50 % lägre risk för plötslig hjärtdöd jämfört med 1 gång/vecka.
Lägre risk för hjärtinfarkt, stroke och demens.
Sambandet var dosberoende (ju oftare, desto starkare effekt).
Andra studier
Bastu förbättrar arteriell compliance (elasticitet i blodkärl).
Regelbundet bastubad associeras med längre hälsospan snarare än enbart livslängd.
Sammanfattning:
Bastu fungerar som en form av ”passiv träning” och hormetisk stress, där kroppen svarar på värmechocken genom att aktivera reparativa mekanismer.
Effekterna på åldrandet inkluderar:
Bättre hjärt-kärlhälsa (lägre blodtryck, minskad risk för hjärtdöd)
Skydd mot kognitiv nedgång och demens
Aktivering av Heat Shock Proteins → cellreparation och proteinbalans
Minskad låggradig inflammation
Förbättrad metabolism och insulinkänslighet
Slutsats: Regelbundet bastubad är vetenskapligt kopplat till lägre risk för hjärt- och hjärnsjukdomar samt förlängd hälsospan, och mekanismerna överlappar med de mest studerade longevity-interventionerna som träning och fasta.
Tunnare vävnad (atrofi)
Östrogen stimulerar normalt tillväxt av epitelceller i vaginans slemhinna.
När östrogenet sjunker → epitelet blir tunnare, ibland bara några cellager tjockt (jämfört med många lager tidigare).
Minskad kollagen och elasticitet
Kollagenproduktionen minskar → vävnaden blir mer skör och förlorar spänst.
Vaginalväggarna kan kännas “slappare” men samtidigt mer ömtåliga.
Mindre blodflöde
Östrogen stimulerar kärlgenomblödning. Utan det → mindre blodcirkulation, sämre syresättning och tunnare vävnad.
Mindre naturlig fukt
Färre körtlar aktiveras → torrare miljö.
Mindre glykogen i cellerna → laktobaciller minskar → pH stiger (från ~4 → 6–7).
Symtom
Vaginal torrhet, sveda, klåda, ömhet.
Smärta vid samlag (dyspareuni).
Ökad risk för småsprickor, irritation och urinvägsinfektioner
Vaginal pH
Normalt hos fertila kvinnor: 3,5–4,5 (tack vare östrogen som gynnar laktobaciller).
Efter menopaus utan östrogen: 5,0–7,0.
→ Högre pH = mindre skydd, torrare och skörare miljö.
Vaginal Maturation Index (VMI)
Mikroskopisk analys av celler i slemhinnan.
Hög östrogen: många ytliga, mogna celler.
Lågt östrogen: dominans av omogna basalceller → tunnare och torrare slemhinna.
Vaginal fukthalt (hydrering) – mätt med instrument eller histologi
Studier har visat att vätskeinnehållet i vaginalvävnad sjunker markant efter menopaus.
Exempel: En studie fann ~30–40 % lägre vätskeinnehåll i postmenopausal vaginalvävnad jämfört med premenopausal (Leiblum et al., 2009).
Blodflöde i slemhinnan (Doppler)
Östrogen ökar blodflödet → bättre syresättning och fukt.
Vid brist minskar blodflödet → torrare och tunnare vävnad
Hos kvinnor bidrar östrogenförlust, insulinresistens, kortisolpåverkan, sarkopeni och inflammatoriska processer tillsammans till att fett depåerna omfördelas och mer lagras i buken med stigande ålder.
1. Minskade östrogennivåer
Östrogen stimulerar fettlagring i gluteofemorala depåer (höfter och lår).
När östrogenet sjunker vid menopaus, sker en redistribution av fett från perifera depåer till visceralt (bukfett).
Detta kallas ibland för en övergång från ett "päronformat" till ett mer "äppelformat" kroppsmönster.
2. Förändrad insulinkänslighet
Med åldern och minskat östrogen försämras insulinsignaleringen.
Sämre insulinkänslighet gör att glukos inte tas upp lika effektivt i muskler, vilket gynnar fettinlagring i lever och buk.
Kortisol och stressaxeln
Långvarigt lätt förhöjt kortisol (vanligt vid åldrande och sömnbrist) gynnar abdominal fettinlagring.
Kortisol aktiverar lipoprotein lipas mer i bukfettväv än i gluteofemoral vävnad.
4. Minskad muskelmassa (sarkopeni)
Muskler förbrukar mycket energi.
Minskad muskelmassa → lägre basalmetabolism → lättare energibalansöverskott → fett lagras i buken där blodflödet är högt och fettmobilisering sker snabbt.
5. Inflammatoriska processer
Visceralt fett är mer metabolt aktivt än subkutant fett.
När visceralt fett ökar, produceras mer cytokiner (t.ex. TNF-α, IL-6) vilket kan ytterligare driva insulinresistens och fettinlagring i en ond cirkel.
Kvinnors åldrande präglas av en dramatisk hormonell vändpunkt (menopaus) → snabbare metabola och kroppsliga förändringar då.
Män åldras mer jämnt, men med större risk för tidig död i hjärt-kärlsjukdomar.
Kvinnor lever längre men har fler kroniska besvär på ålderns höst.
Hormonella skillnader
Kvinnor:
Genomgår en abrupt hormonförändring vid menopaus (ca 45–55 år) → kraftigt fall i östrogen och progesteron.
Detta påverkar fettfördelning, benhälsa, hud, kognition och kardiovaskulär risk.
Män:
Upplever ett mer gradvis fall i testosteron (ca 1 % per år från 30–40 års ålder).
Förändringarna är långsammare, men påverkar muskelmassa, bentäthet, energi och libido.
Stor skillnad: Kvinnors åldrande får en tydlig “knäckpunkt” (menopaus), medan män åldras mer linjärt.
Kroppssammansättning
Kvinnor: Tappar östrogenets skydd → mer bukfett, insulinresistens och risk för metabolt syndrom.
Män: Har generellt mer visceralt fett redan från början, men får progressiv muskelförlust och risk för testosteronbrist.
Biologisk livslängd
Kvinnor lever i snitt 4–7 år längre än män globalt.
Möjligen tack vare östrogenets skyddande effekt mot hjärt-kärlsjukdom fram till menopaus, samt genetiska faktorer (kvinnor har två X-kromosomer).
Män åldras snabbare biologiskt i flera biomarkörer (t.ex. epigenetiska klockor visar ofta att män har en högre “biologisk ålder” än kvinnor i samma kronologiska ålder).
Sjukdomsprofil
Kvinnor:
Mer benägenhet för autoimmuna sjukdomar och osteoporos.
Högre risk för Alzheimers efter menopaus.
Män:
Högre risk för hjärt-kärlsjukdom, cancer och metabolt syndrom tidigare i livet.
Dör oftare i “snabba sjukdomar”, medan kvinnor oftare får kroniska åkommor.
Kvinnor drabbas mer av Alzheimers eftersom östrogenförlust, genetik (APOE ε4), immunsystemets funktion och metabola förändringar samverkar. Östrogenets plötsliga bortfall vid menopaus verkar vara den största skillnaden jämfört med män
1. Hormonella förändringar (östrogenets roll)
Östrogen har en skyddande effekt på hjärnan – det påverkar synaptisk plasticitet, mitokondriernas energiproduktion och minskar inflammation.
Vid menopaus faller östrogennivåerna snabbt → hjärnan blir mer sårbar för amyloid-beta-ansamling och tau-patologi (de proteinförändringar som driver Alzheimers).
Därför ser man ofta en acceleration av kognitiv försämring hos kvinnor efter klimakteriet.
2. Genetik och riskgener
APOE ε4-genen, den starkaste genetiska riskfaktorn för Alzheimers, har större effekt hos kvinnor än hos män.
Kvinnliga bärare av APOE ε4 har ungefär dubbelt så hög risk som manliga bärare.
Möjligen på grund av samspelet mellan APOE och könshormoner.
3. Immun- och inflammationsskillnader
Kvinnor har generellt ett starkare immunsystem (p.g.a. två X-kromosomer och hormoner).
Men detta innebär också större risk för överaktivering av mikroglia (hjärnans immunceller), vilket kan leda till kronisk inflammation och neurodegeneration.
4. Metabol och vaskulär påverkan
Kvinnor får efter menopaus ökad risk för insulinresistens, metabola störningar och hjärt-kärlsjukdomar, som i sin tur är starkt kopplade till kognitiv nedgång.
Insulinresistens påverkar hur hjärnan använder glukos, vilket kallas ibland för "typ 3-diabetes" i Alzheimersforskning.
5. Livslängd och diagnosfaktorer
Kvinnor lever längre, vilket ökar den absoluta risken att nå en ålder där Alzheimers är vanlig.
Men även efter justering för livslängd är risken högre hos kvinnor, vilket talar för biologiska orsaker.
Mekanismer – hur kokain påverkar kroppen och åldrandet
1. Oxidativ stress & cellskador
Kokain ökar frisättningen av dopamin i hjärnan, men när dopamin bryts ner bildas reaktiva syreradikaler (ROS).
Detta leder till oxidativ stress → skadar cellmembran, proteiner och DNA.
Studier visar att kokainbruk är kopplat till kortare telomerer (DNA:s ändskydd), vilket är en tydlig markör för accelererat åldrande.
2. Kardiovaskulärt åldrande
Kokain ger akut blodtrycks- och pulshöjning samt drar ihop blodkärlen (vasokonstriktion).
Detta ökar risken för hjärtinfarkt, stroke och hjärtsvikt även hos unga användare.
Kronisk användning ger åderförkalkning (ateroskleros) snabbare än normalt → ”föråldrat” hjärtkärlsystem.
3. Neurodegeneration & hjärnan
Upprepad dopaminfrisättning → nedreglering av dopaminreceptorer → försämrad kognition, motivation och belöningssystem.
Kokain kan skada hjärnans vita substans och bidra till neuroinflammation.
Detta påskyndar processer som liknar dem vid neurodegenerativa sjukdomar (t.ex. Parkinsons, demens).
4. Inflammation & immunförsvar
Kokain höjer nivåerna av pro-inflammatoriska cytokiner (IL-6, TNF-α).
Kronisk låggradig inflammation är en central mekanism i åldrandet, kallad inflammaging.
Immunförsvaret försvagas också, vilket gör kroppen mer mottaglig för infektioner.
5. Metabolism & hormoner
Kokain kan påverka kortisolnivåer (stresshormon) och bidra till kronisk stresspåverkan.
Kroniskt högt kortisol → muskelnedbrytning, bukfetma, insulinresistens och snabbare biologiskt åldrande.
6. Telomerer & biologisk ålder
Flera studier har funnit att personer som använder kokain regelbundet har signifikant kortare telomerer än jämnåriga.
Kortare telomerer = snabbare biologiskt åldrande och högre risk för sjukdom och tidig död.
Evidens från studier
En amerikansk studie på kokainanvändare visade att de i snitt hade 7–8 års accelererat biologiskt åldrande mätt via epigenetiska klockor och telomerlängd.
Kokainanvändning är associerad med ökad mortalitet redan i yngre åldrar, främst via hjärt-kärlsjukdom, stroke och infektioner.
Sammanfattning
Kokain accelererar åldrandet genom flera mekanismer:
↑ Oxidativ stress och DNA-skador
↑ Kardiovaskulärt slitage (hjärta/kärl)
↑ Neuroinflammation och kognitiv nedgång
↑ Systemisk inflammation
↓ Telomerlängd och epigenetisk stabilitet
Slutsats:
Kokain är ett av de mest kraftfullt pro-aging-substanserna man kan utsätta kroppen för – både genom akuta risker (hjärtinfarkt, stroke) och genom kroniska förändringar som påskyndar biologiskt åldrande.
Alkohol (etanol) bryts ned till acetaldehyd, en mycket reaktiv och giftig molekyl.
Acetaldehyd bildar addukter med DNA och proteiner → mutationer, försämrad DNA-reparation och cancerrisk.
Alkohol ökar produktionen av reaktiva syreradikaler (ROS) i lever och andra organ → oxidativ stress som driver cellulärt åldrande.
2. Telomerer & epigenetiskt åldrande
Stora epidemiologiska studier visar att högt alkoholintag är associerat med kortare telomerer – en central biomarkör för biologiskt åldrande.
Alkohol förändrar DNA-metylering och epigenetiska mönster, vilket kan driva epigenetisk acceleration av åldrandet (mätt med epigenetiska klockor).
3. Hjärta & kärl
Måttlig konsumtion har tidigare kopplats till viss kardioprotektion (s.k. ”franska paradoxen”), men nyare genetiska studier (Mendelian randomization) talar starkt emot att alkohol i sig har skyddande effekter.
Hög konsumtion ökar risken för högt blodtryck, arytmier, stroke och kardiomyopati.
Alkohol ökar också mängden oxiderat LDL och främjar åderförkalkning – alltså snabbare kärlåldrande.
4. Hjärnan & neurodegeneration
Alkohol är neurotoxiskt – det orsakar volymförlust i hjärnan även vid måttlig konsumtion (särskilt i hippocampus, centrum för minne).
Kronisk konsumtion leder till nedsatt neurogenes och kan påskynda demensutveckling.
Alkohol orsakar också neuroinflammation och försämrar BDNF-signalering (viktigt för plasticitet och hjärnhälsa).
5. Inflammation & immunförsvar
Alkohol ökar tarmpermeabilitet → bakterieendotoxiner (LPS) läcker in i blodet → kronisk låggradig inflammation.
Försvagar immunförsvaret → sämre infektionsförsvar och långsammare sårläkning.
Kronisk inflammation är en drivande mekanism i åldrandet (”inflammaging”).
6. Metabolism, hormoner & åldrande
Alkohol stör insulinsignalering → ökad risk för insulinresistens och typ 2-diabetes.
Ökar bukfetma (visceralt fett) → kopplat till kardiovaskulär risk och förkortad livslängd.
Sänker testosteron hos män och stör östrogenbalansen hos kvinnor → påverkar muskler, ben och fertilitet.
Evidens i människor
Telomerstudier: Tunga alkoholbrukare har upp till 4–6 år kortare biologisk ålder jämfört med icke-drickare.
Mortalitetskurva: Alkohol följer en J-formad kurva – mycket högt intag = kraftigt förhöjd dödlighet. Nyare data tyder på att även låg till måttlig konsumtion (1–2 glas vin/dag) är associerad med ökad cancerrisk (bröstcancer, levercancer, munhålecancer).
WHO klassar alkohol som grupp 1-carcinogen, samma kategori som tobak.
Sammanfattning
Alkohol påskyndar åldrandet via flera mekanismer:
↑ Oxidativ stress och DNA-skador (acetaldehyd, ROS)
↑ Epigenetisk acceleration och kortare telomerer
↑ Kärlåldrande (ateroskleros, blodtryck)
↑ Neurodegeneration och minnesförlust
↑ Inflammation & immunsvaghet
↓ Hormonbalans, muskler och metabolism
Slutsats:
Alkohol är en av de mest etablerade pro-aging-faktorerna i vardagen. Även små mängder kan öka cancerrisk, och det vetenskapliga konsensus rör sig allt mer mot att ”ingen mängd alkohol är helt säker” för långsiktig hälsa.






Bli din kropps bästa vän!